Konceptet av hybridisering definieras som processen att kombinera två atomära orbitaler för att skapa en ny typ av hybridiserade orbitaler. Denna sammanblandning resulterar vanligtvis i bildandet av hybridorbitaler med helt olika energier, former och så vidare. Hybridisering utförs i första hand av atomära orbitaler med samma energinivå. Men både helt fyllda och halvfyllda orbitaler kan delta i denna process om deras energier är lika. Begreppet hybridisering är en förlängning av valensbindningsteorin som hjälper oss att förstå bindningsbildning, bindningsenergier och bindningslängder.
Vad är hybridisering?
När två atomära orbitaler kombineras för att bilda en hybridorbital i en molekyl, omfördelas energin i orbitaler av enskilda atomer för att ge orbitaler med ekvivalent energi. Detta är känt som hybridisering.
Atomorbitalerna för jämförbara energier blandas samman under hybridiseringsprocessen, som mestadels involverar sammanslagning av två orbitaler eller två 'p' orbitaler eller blandning av en 's' orbital med en 'p' orbital såväl som en 's' orbital med en 'd' orbital.
Hybrida orbitaler är de nya orbitaler som bildas som ett resultat av denna process. Ännu viktigare är att hybridorbitaler kan användas för att förklara atombindningsegenskaper och molekylär geometri. Kol bildar till exempel fyra enkelbindningar där valensskalets orbitaler kombineras med tre valensskals p-orbitaler. Denna kombination genererar fyra ekvivalenta sp3blandningar. Dessa kommer att arrangeras i ett tetraedriskt mönster runt kolet, som är bundet till fyra olika atomer.
Steg för att bestämma typen av hybridisering
För att förstå typen av hybridisering i en atom eller en jon måste följande regler följas.
- Bestäm först det totala antalet valenselektroner som finns i en atom eller jon.
- Räkna sedan antalet ensamma par kopplade till den atomen eller jonen.
- Nu kan antalet orbitaler som krävs beräknas genom att lägga till antalet duplex eller oktett och antalet ensamma elektronpar.
- Det bör noteras att geometrin för orbitaler i atomer eller joner är annorlunda när det inte finns något ensamt elektronpar.
Funktioner av hybridisering
- Hybridisering sker mellan atomära orbitaler med lika energier.
- Antalet hybridorbitaler som bildas är lika med antalet atomära orbitaler som blandas.
- Det krävs inte för alla halvfyllda orbitaler att delta i hybridisering. Även orbitaler som är helt fyllda men har lite varierande energi kan delta.
- Hybridisering sker endast under bindningsbildning, inte i en enda gasformig atom.
- Om hybridiseringen av molekylen är känd kan molekylens form förutsägas.
- Hybridorbitalens större lob är alltid positiv, medan den mindre loben på den motsatta sidan alltid är negativ.
Typer av hybridisering
Hybridisering kan klassificeras som sp3, sp2, sp., sp3d, sp3d2eller sp3d3baserat på de typer av orbitaler som ingår i blandningen.
sp Hybridisering
Det inträffar när en s och en p-orbital i en atoms huvudskal kombineras för att bilda två nya ekvivalenta orbitaler. De nybildade orbitaler är kända som sp-hybridiserade orbitaler. Den producerar linjära molekyler i 180° vinkel. Det innebär att man kombinerar sin orbital och en 'p' orbital med lika energi för att producera en ny hybrid orbital känd som en sp hybridiserad orbital.
- Det är också känt som diagonal hybridisering.
- Varje sp-hybridiserad orbital innehåller samma mängd s- och p-tecken.
- Alla berylliumföreningar, såsom BeF2, Tja2och BeCl2, är exempel.

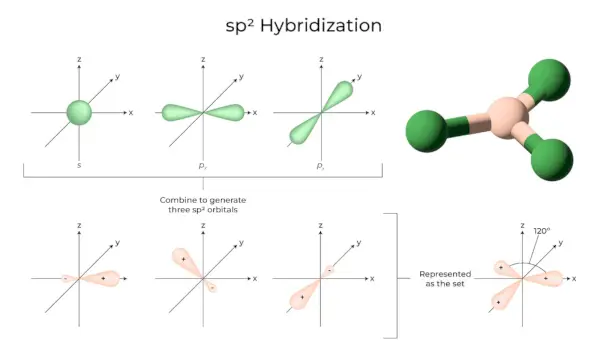
sp2Hybridisering
Det uppstår när en s och två p-orbitaler av samma atoms skal kombineras för att bilda tre ekvivalenta orbitaler. De nybildade orbitalen är kända som sp2hybridorbitaler. Det är också känt som trigonal hybridisering. Det innebär att man kombinerar sin orbital med två 'p' orbitaler med lika energi för att skapa en ny hybrid orbital känd som sp2. En trigonal symmetriblandning av s- och p-orbitaler hålls vid 120 grader. Alla tre hybridorbitaler förblir i samma plan och bildar en 120° vinkel med varandra.
typgjutning och typkonvertering i java
- Varje hybridorbital som bildas har 33,33 % och 66,66 % 'p'-karaktär.
- Molekylerna med en triangulär plan form har en central atom som är kopplad till tre andra atomer och är sp2hybridiserades. Borföreningar är exempel.
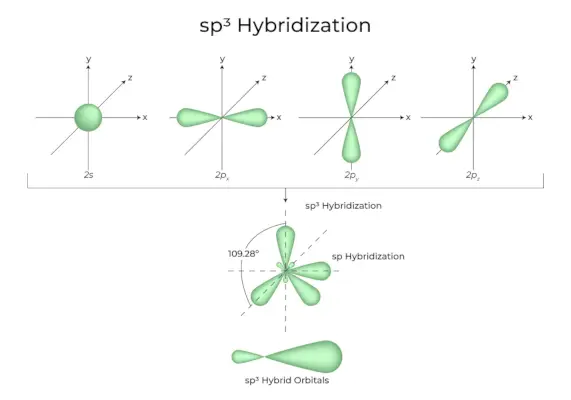
sp3Hybridisering
När en 's' orbitaler och tre 'p' orbitaler från samma skal av en atom kombineras för att bilda fyra nya ekvivalenta orbitaler, är hybridiseringen känd som tetraedrisk hybridisering eller sp3. De nybildade orbitalen är kända som sp3hybridorbitaler. Dessa pekar mot de fyra hörnen av en vanlig tetraeder och bildar en 109°28′ vinkel med varandra.
- Sp3hybridorbitaler bildar en 109,28 graders vinkel.
- Varje hybridorbital har 25 % s-karaktär och 75 % p-karaktär.
- Etan och metan är två exempel.
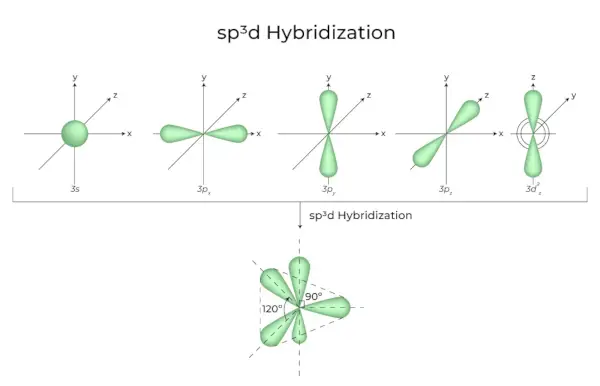
sp3d Hybridisering
Blandningen av 1s orbitaler, 3p orbitaler och 1d orbitaler resulterar i 5 sp3d hybridiserade orbitaler med lika energi. Deras geometri är trigonal bipyramidal. Kombinationen av s, p och d orbitaler resulterar i trigonal bipyramidal symmetri. Ekvatorialorbitalerna är tre hybridorbitaler som är orienterade i 120° vinkel mot varandra och ligger i horisontalplanet.
- De återstående två orbitaler, kända som axiella orbitaler, är i vertikalplanet vid 90 graders plan av ekvatorialorbitalerna.
- Hybridisering i fosforpentaklorid, till exempel (PCl5).
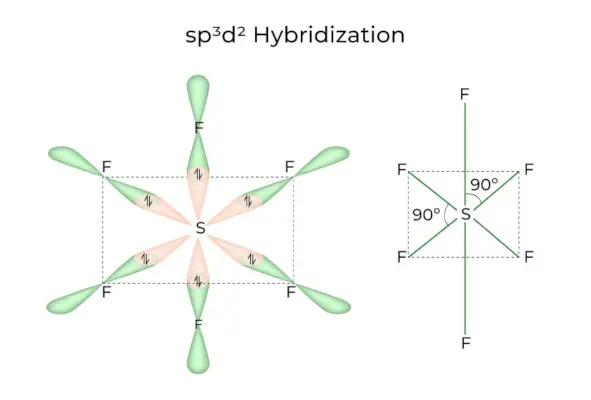
sp3d2 Hybridisering
När 1s, 3p och 2d orbitaler kombineras för att bilda 6 identiska sp3d2hybridorbitaler kallas hybridiseringen sp3d2Hybridisering. Dessa sju orbitaler pekar mot hörnen av en oktaeder. De lutar i 90 graders vinkel mot varandra.
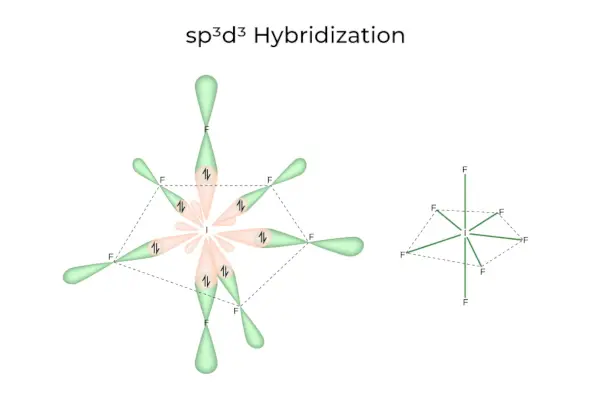
sp3d3Hybridisering
Den har 1s, 3p och 3d orbitaler, som kombineras för att bilda 7 identiska sp3d3hybridorbitaler. Dessa sju orbitaler pekar mot hörnen av en femkantig bipyramidal. t.ex. OM6.
Former av hybridisering
- Linjär: sp-hybridiseringen orsakas av interaktionen av två-elektrongrupper; omloppsvinkeln är 180°. Trigonal planar: Tre elektrongrupper är inblandade, vilket resulterar i sp2hybridisering; orbitalerna är 120° från varandra. Tetraedrisk: Fyra elektrongrupper är inblandade, vilket resulterar i sp3hybridisering; omloppsvinkeln är 109,5°. Trigonal bipyramidal: Fem elektrongrupper är inblandade, vilket resulterar i sp3d hybridisering; omloppsvinklarna är 90° och 120°. Octahedral: Sex elektrongrupper är inblandade, vilket resulterar i sp3d2hybridisering; orbitalerna är 90° från varandra.
Vanliga frågor på Hybridisering
Fråga 1: Vilken hybridorbital är mer elektronegativ bland sp, sp2 och sp3?
Svar:
Procentandelen av s tecken i sp, sp2och sp3hybridiserat kol är 50 %, 33,33 % respektive 25 %. På grund av den sfäriska formen på s omloppsbanan attraheras den jämnt från alla håll av kärnan. Som ett resultat kommer en hybridorbital med s-karaktär att vara närmare kärnan och därmed mer elektronegativ. Som ett resultat är det sp-hybridiserade kolet det mest elektronegativa.
Fråga 2: Vad är hybridorbitaler?
Svar:
Hybridorbitaler bildas genom att kombinera standardatomorbitaler och resultera i bildandet av nya atomära orbitaler.
Fråga 3: Vilka är de fem formerna av hybridisering?
Svar:
stränghantering i c++
Linjär, trigonal plan, tetraedrisk, trigonal bipyramidal och oktaedrisk är de fem grundläggande formerna för hybridisering.
Fråga 4: Varför ser amidmolekylen ut som sp3hybridiserad men är sp2?
Svar:
Om atomen antingen är innesluten av två eller flera p-orbitaler eller har ett ensamt par som kan hoppa in i en p-orbital, kommer den allmänna hybridiseringsprocessen att förändras. Som ett resultat, i fallet med en amidmolekyl, går det ensamma paret in i en p-orbital, vilket resulterar i tre intilliggande parallella p-orbitaler.
Fråga 5: Vad är Bents regel?
Svar:
En central atom kopplad till ett flertal grupper i en molekyl kommer att hybridisera, vilket gör att orbitaler med mer s-karaktär riktas mot elektropositiva grupper och orbitaler med mer p-karaktär riktas mot elektronegativa grupper.
