Bas är en kemisk förening som består av OH–joner och tar emot protoner. Bas i kemi är de föreningar som blir röd lackmusblå och när de reagerar med syra neutraliserar de reaktionen för att ge salt och vatten. Basens pH-värde är större än 7. Baser är beska i smaken och hala i kontakten. Baserna som är lösliga i vatten kallas alkalier. Exempel på baser är metalloxider, metallhydroxider etc. Tvål är ett exempel på en bas som vi använder i det dagliga livet. I den här artikeln kommer vi att lära oss om definitionen, egenskaperna och kemiska reaktionerna av baser i detalj.

Basdefinition
Bas definieras som den kemiska förening vars pH-värde är högre än 7, accepterar en proton, neutraliserar syra och förvandlar röd lackmus till blå. De befriar i allmänhet OH–jon på dissociation. Exempel inkluderar NaOH, NaHCO3,etc. Följande är några allmänna funktioner som visas av basen:
- De har en bitter smak
- De är hala i kontakten
- De blir röd lackmusblå
- De befriar OH–jon när den löses i vatten
- De leder elektricitet i lösningsform
Baser är en av de viktigaste kemiska föreningarna som används i vardagen. Baser används som antacida för att kontrollera surheten och i tandkräm för att neutralisera den bakteriella verkan som producerar syra i vår mun och förhindrar nedbrytning av emalj och hålrum. De används också som bakpulver, bakpulver och tvättpulver.
Lewis bas
Lewis-baser är de föreningar som har elektronpar och de kan donera det till föreningar som har brist på elektronpar. Lewis-baser är nukleofila till sin natur, dvs de är kärnälskande vilket betyder att de kommer att attackera ett positivt laddat centrum med sina elektronpar. Exempel på Lewis Base inkluderar Ammoniak eftersom i Ammoniak (NH3) centrumatomen kväve har 5 elektroner av vilka 3 används för att göra bindningar med 3 väteatomer och ett elektronpar kvarstår med N-atomen vilket gör NH3en Lewis-bas.
Arrhenius bas
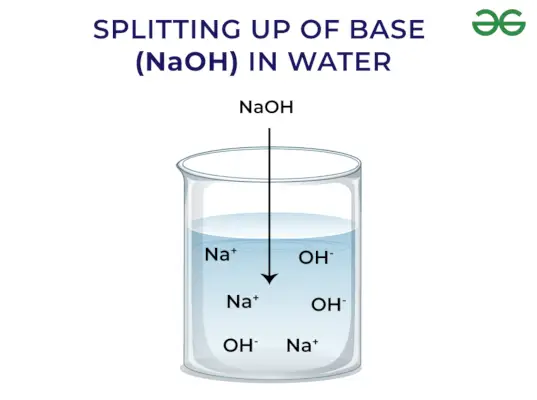
Enligt Arrhenius koncept är baser föreningar som frigör hydroxidjoner när de löses upp i vatten och ökar koncentrationen av hydroxyljoner i vattenlösningen. Till exempel, när KOH löses i vatten kommer det att ge OH–jon och därmed öka koncentrationen av OH–i vattnet.
Bronsted Base
Bronsted Concept of Base är en avancerad version av Arrhenius’ Concept som säger att baser är föreningar som accepterar H+jon eller proton för att bilda sin konjugerade syra. Till exempel Cl–är en bas som accepterar H+för att bilda HCl som dess konjugerade syra.
Typer av baser
Baser kan klassificeras på basis av surhet, koncentration och joniseringsförmåga. Klassificeringen nämns nedan
Typer av baser baserade på surhet
Surhet av en bas hänvisar till antalet utbytbara hydroxylgrupper som finns i en molekyl av basen. Baserat på surhet klassificeras baser i tre kategorier:
- Ensyrlig bas
- Disyrabas
- Triacidisk bas
Ensyra: Mono-sura baser är de som innehåller endast en utbytbar hydroxyljon och interagerar med endast en vätejon. Monosyrabaser inkluderar NaOH, KOH och andra.
Disyrad: Disyrabas är en bas med två utbytbara hydroxyljoner som interagerar med två vätejoner. Ca(OH)2, Mg(OH)2och andra di-sura baser är exempel.
Trisyra: Trisyrabas är en typ av bas som består av tre utbytbara hydroxyljoner och tre vätejoner. Trisyrabaser inkluderar Al(OH)3, Fe(OH)3, och andra.
Typer av baser baserat på deras koncentration i vattenlösning
Koncentration avser mängden bas som finns i en vattenlösning. Baserat på deras koncentration i vattenlösning delas baser in i två kategorier:
s i python
- Koncentrerad bas
- Utspädd bas
Koncentrerad bas: Koncentrerade baser är de där mängden bas är stor jämfört med lösningsmedlet. Koncentrerad NaOH-lösning, till exempel.
Utspädd bas: Dessa typer av baser har en lägre koncentration av bas i sin vattenlösning. Spädning är processen att minska andelen av ett löst ämne genom att tillsätta mer mängd lösningsmedel. Späd till exempel NaOH, späd ut KOH och så vidare.
Typer av baser baserade på joniseringsgrad
Grad av jonisering hänvisar till förmågan hos en kemisk förening att frigöra sin beståndsdeljon när den löses i vatten. När det gäller Base hänvisar graden av jonisering till basens förmåga att frigöra OH–joner när de är lösta i vatten. Baserat på graden av jonisering klassificeras baser i två typer:
- Stark bas
- Svag bas
Stark bas: Starka baser är de baser som dissocierar fullständigt och frigör OH-joner när de löses i vatten. Några exempel på starka baser inkluderar NaOH, KOH, etc.
Svag bas: De baser som inte genomgår fullständig dissociation och frigör endast en bråkdel av OH-joner kallas svag bas. Exempel på svaga baser inkluderar Al(OH)3,Cu(OH)2,etc.
Lär dig mer, Starka och svaga baser
Basernas egenskaper
Eftersom vi vet att baser är kemiska föreningar som har OH-jon, blir röd lackmusblå, etc. I det här avsnittet kommer vi att lära oss om basernas fysikaliska och kemiska egenskaper tillsammans med lite kort kunskap om deras allmänna egenskaper.
Basens allmänna egenskaper
De allmänna egenskaperna för baser nämns nedan:
- En hydroxidjon (OH–) släpps ut i vattnet av baser. Ju starkare basen blir när fler joner frigörs.
- Baser reagerar med syra för att bilda salt Syror reagerar med baser. Denna reaktion av en bas med syra kallas en neutraliseringsreaktion.
- Baser blir röd lackmus till blå.
- Ett proteins struktur kan förändras av baser. Baser har denna kvalitet, vilket gör att de känns slanka. Tvål är en bas som blir otroligt hal på huden när den är våt. På grund av deras förmåga att modifiera strukturen hos proteiner är vissa kraftfulla baser extremt farliga.
Fysiska egenskaper hos baser
Baser smakar bittert: Baser är bittra i smaken. På grund av dess bitterhet har vi bara ett fåtal alkaliska livsmedel. Det finns bara ett fåtal alkaliska livsmedelsmaterial. Baser måste smakas med mer försiktighet jämfört med syror.
Baserna är hala i kontakten: Vid beröring känns baserna hala. Till exempel tvål.
Baser släpper OH – Jon: När baser löses i vatten frigör de hydroxyljon (OH–). Beroende på förmågan att frigöra hydroxyljoner klassificeras de som starka och svaga.
Baser neutraliserar syror: När baser reagerar med syror neutraliserar de varandra och producerar salt och vatten. Denna reaktion kallas Neutraliseringsreaktion . Låt oss säga att vi har syran HY och basen 'XOH', då blir saltet som bildas 'XY'. Ekvationen för denna reaktion kan ges som HY + XOH → HOH + XY.
Baser Denature Protein: Denaturering av protein betyder förstörelse av proteinets stabilitet och struktur. Detta gör användningen av bas skadlig för människor eftersom mänsklig hud och hår består av protein och när starka alkalier som natrium- eller kaliumhydroxid även kallad lut används skapar de en skadlig inverkan på mänsklig hud.
Baser förvandlar röd lackmus till blå: När baser kommer i kontakt med röd lackmus blir den blå. Det bör dock noteras att ingen sådan förändring kan observeras när vi försöker reagera torr bas med rött lackmuspapper. Lakmuspapperstestet är en av de äldsta metoderna för att testa basen. Men det finns även andra indikatorer som fenolftalein
Baser leder elektricitet: När baser är i lösningsform har de mobil OH-jon och kan därför leda elektricitet.
Basernas kemiska egenskaper
- Reaktion av bas med metaller: När alkali (bas) reagerar med metall bildas salt och vätgas.
Alkali + Metall → Salt + Väte
Exempel:
- När natriumhydroxid interagerar med aluminiummetall, bildas natriumaluminat och vätgas.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- När natriumhydroxid interagerar med zinkmetall, producerar den vätgas och natriumzinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reaktion av icke-metalliska oxider med bas: Salt och vatten bildas när icke-metalliska oxider reagerar med en bas.
Icke-metallisk oxid + Bas → Salt + Vatten
När kalciumhydroxid, en bas reagerar med koldioxid, bildas kalciumkarbonat och vatten.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reaktion av alkali/bas med ammoniumsalter: Ammoniak bildas när alkalier reagerar med ammoniumsalter.
Alkali + Ammoniumsalt → Salt + Vatten + Ammoniak
När kalciumhydroxid reagerar med ammoniumklorid bildas kalciumkloridvatten och ammoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Exempel på baser
Baser är generellt metalloxid, metallhydroxid, metallvätekarbonat, metallkarbonater etc. Låt oss se några av exemplen på baser med deras tillämpning i tabellform:
| Baser gimp-teckensnittslista | Ansökningar |
|---|---|
| Kaliumhydroxid KOH | Används i alkaliska batterier |
| Natriumhydroxid NaOH | Används vid tillverkning av tvål och tvättmedel |
| Magnesiumhydroxid Mg(OH) 2 | Används som antacida |
| Natriumbikarbonat NaHCO 3 | Används som bakpulver |
| Natriumkarbonat Redan 2 CO 3 | Används som tvättläsk |
| Ammoniak NH 3 | Används vid tillverkning av rengörings- och läkemedelsprodukter preg_match |
| Kalcium hydroxid Ca(OH) 2 | Används i White Washing |
Användning av baser
Det finns olika användningsfall av bas, några av dessa är:
- Natriumhydroxid används vid tillverkning av tvål och papper. Natriumhydroxid (NaOH) används också vid framställning av rayon.
- Blekningspulver är tillverkat av Ca(OH)2, allmänt känd som släckt kalk eller kalciumhydroxid.
- Kalciumhydroxid används för att skapa torra blandningar för målning och dekoration.
- Magnesiumhydroxid, populärt känd som magnesiamjölk, är ett laxermedel som används flitigt. Det används också som antacida eftersom det minskar överskott av surhet i människans mage.
- I laboratorier är ammoniumhydroxid ett kritiskt reagens.
- Släckt kalk kan användas för att neutralisera eventuell överflödig surhet i jordar.
Läs mer
- Syra, bas och salt
- Syrans styrka
- Jonisering av syra och bas
Vanliga frågor om baser i kemi
1. Vad är baser?
- Basföreningar har en bitter smak till dem.
- Konsistensen på de flesta baser är tvålaktig.
- När den testas på lackmuspapper förvandlar den i de flesta fall rött lackmuspapper till blått lackmuspapper.
- I lösning leder basföreningarna också elektricitet.
- När basföreningar löses i vatten frigörs OH-joner.
2. Vilka funktioner har baser?
Hemma använder vi baser som rengöringsmedel och antacida. Tvål, lut (som används i ugnsrengöringsmedel), magnesiamjölk och Tums är alla exempel på populära hemgjorda baser. Var och en av dem har ett pH högre än sju, kan konsumera fritt väte och neutralisera syror.
3. Vilken är den viktigaste skillnaden mellan en syra och en bas?
Syror och baser är två typer av frätande kemikalier. Sura material har ett pH-värde mellan 0 och 7, medan baser har ett pH-värde mellan 7 och 14. Syror är joniska kemikalier som bryts ner i vatten för att skapa vätejonen (H+) medan Base dissocierar och ger OH-jon.
4. Vilka är de fysiska egenskaperna hos baser?
- De har en bitter smak.
- Deras vattenlösningar har en tvålaktig kvalitet.
- De ändrar färgen på lackmuspapper från rött till blått.
- Deras vattenlösningar är elektriskt ledande.
- Med frigörandet av vätgas reagerar baser med metaller för att generera salt.
5. Vad händer när kalciumhydroxid reagerar med ammoniumklorid?
När kalciumhydroxid reagerar med ammoniumklorid bildas kalciumkloridvatten och ammoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Vad händer när natriumhydroxid reagerar med zinkmetall?
När natriumhydroxid interagerar med zinkmetall, producerar den vätgas och natriumzinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Vad är Lewis Base?
Lewis Base är föreningarna som donerar ett elektronpar till den elektronbristiga föreningen. Exempel inkluderar NH3.
8. Vad är baser gjorda av?
Baser består i allmänhet av OH–Jon. Förutom dessa metalloxider är karbonater och vätekarbonater också baser.
9. Vad är alkalier?
De baser som är lösliga i vatten kallas alkalier. Ett exempel är natriumhydroxid NaOH.
10. Vad är stark bas och svag bas?
Baserna som dissocierar fullständigt för att ge OH–joner vid upplösning i vatten kallas Strong Base. Exempel inkluderar NaOH. Svaga baser är de som inte dissocierar helt för att frigöra OH–jon kallas en svag bas. Exempel på svaga baser inkluderar ammoniumhydroxid.
