Atomorbitaler , som är matematiska funktioner, beskriver vågbeteendet hos elektroner (eller elektronpar) i en atom. Atomorbitaler har olika former beroende på deras typ. De olika formerna av atomorbitaler beskriver att det finns antingen den högsta eller noll sannolikheten att hitta en elektron runt kärnan i vissa riktningar. Det finns fyra typer av orbitaler, var och en med olika form och representerade av bokstäverna s, p, d och f. s- och p-orbitalerna tas med i beräkningen eftersom de är vanligast i kemisk och biologisk kemi. En s-orbital har en sfärisk kärna i mitten, en p-orbital är hantelformad, och fyra av de fem d orbitaler är klöverbladsformade. Den femte d-orbitalen är formad som en lång hantel med en munk i mitten. En atoms orbitaler är organiserade i lager eller elektronskal.
Vad är atomorbitaler?
Atomorbitaler är det tredimensionella utrymmet nära en atoms kärna där möjligheten att upptäcka en elektron är maximal.
En atom kan enligt kvantatommodellen ha ett oändligt antal orbitaler. Dessa orbitaler kan klassificeras baserat på deras storlek, form eller orientering. En smalare orbital betyder att det finns en bättre sannolikhet att fånga en elektron nära kärnan. Orbitalvågfunktionen är ofta känd som en matematisk funktion som används för att uttrycka koordinaterna för en elektron. Sannolikheten för att lokalisera en elektron representeras av kvadraten på orbitalvågfunktionen. Denna vågfunktion hjälper också till att skapa gränsytdiagram.
Orbital vågfunktion
De kvantatommodell förutspår att en atom kan ha en stor variation av orbitaler. Dessa orbitaler kan grupperas efter deras storlek, geometri eller lutning. En minskad orbitalstorlek ökar sannolikheten för att få en elektron nära kärnan. Den matematiska funktion som används för att representera en elektrons koordinater kallas orbitalvågsfunktion . Sannolikheten att upptäcka en elektron representeras av kvadraten på orbitalvågfunktionen.
Vi kan också använda denna vågfunktion för att skapa gränsytdiagram. Vi kan bättre förstå formen av orbitaler genom att använda gränsytdiagram av den konstanta sannolikhetstätheten för olika orbitaler.
js laddas
Former av atomorbitaler
Atomorbitalernas former varierar. Det vill säga, sannolikhetsfördelningarna för elektronerna de beskriver kring kärnan är olika. Det faktum att elektronerna i olika orbitaler sannolikt finns i olika områden runt moderkärnan och därför upplever den senares attraktion med olika styrkor är en av anledningarna till att orbitaler varierar i energi. Det är häpnadsväckande att alla orbitaler i ett givet skal av väteatomen har samma energi samtidigt som de har olika former. Detta beror på att olika energirelaterade bidrag elimineras.
Men så fort det finns en andra elektron försvinner degenerationen.
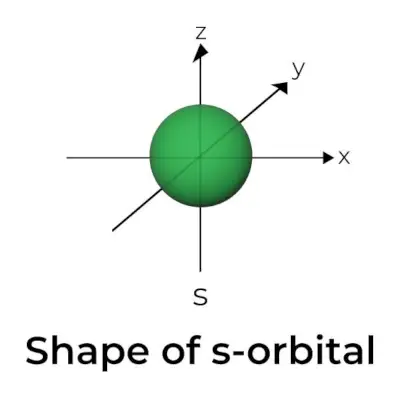
Form av s-orbital
- Ytdiagrammet för s omloppsbana liknar en sfär med kärnan i centrum, vilket kan visas i två dimensioner som en cirkel.
- s-orbitaler är sfäriskt symmetriska, vilket innebär att sannolikheten att hitta en elektron på ett givet avstånd är densamma i alla riktningar.
- Storleken på s-orbitalen visas också öka när värdet på det primära kvanttalet (n) ökar; alltså 4s> 3s> 2s> 1s.
- Nodalpunkten är en plats där det inte finns någon chans att lokalisera elektronen. Noder klassificeras i två typer: radiella noder och vinkelnoder. Avståndet från kärnan beräknas av de radiella noderna, medan orienteringen bestäms av vinkelnoderna.
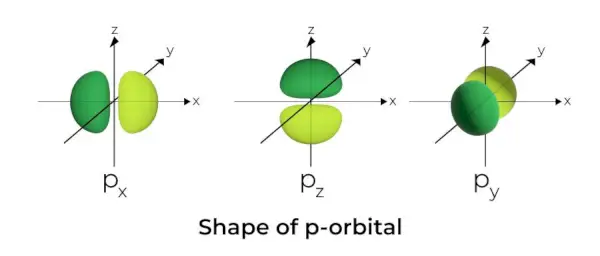
Form av p-Orbital
- P-orbitalerna är utformade som hantlar.
- Den p-orbitala noden är belägen i kärnans centrum.
- På grund av närvaron av tre orbitaler kan p-orbitalen uppta maximalt sex elektroner.
- Varje p-orbital består av två delar som kallas lober som är belägna på vardera sidan av planet som löper över kärnan.
- Varje p-orbital har delar som kallas lober på vardera sidan av planet som löper över kärnan. I det plan där de två loberna skär varandra är sannolikheten noll för att hitta en elektron.
- De tre orbitalerna är kända som degenererade orbitaler eftersom de har samma storlek, form och energi.
- Den enda skillnaden mellan orbitaler är lobernas orientering. Eftersom loberna är orienterade längs x-, y- eller z-axeln får de namnen 2px, 2py, och 2pz. Formeln n –2 används för att beräkna antalet noder.
- På samma sätt som s-orbitaler ökar storleken och energin hos p-orbitaler när det primära kvanttalet ökar (4p> 3p> 2p).
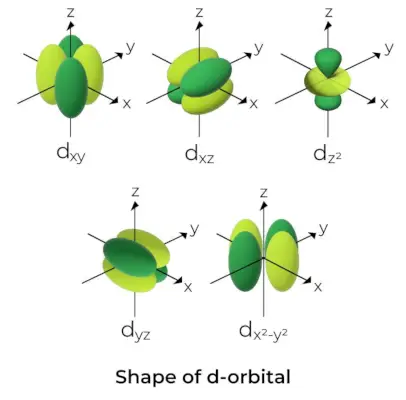
Form av d-Orbital
- För d orbitaler anges det magnetiska orbitala kvanttalet som (-2,-1,0, 1,2). Som ett resultat kan vi hävda att det finns fem d-orbitaler.
- Dessa orbitaler betecknas med symbolerna dxy, dyz, dxz, dx2-och2och dMed2.
- Formerna för de fyra första d-orbitalerna liknar varandra, vilket skiljer sig från dMed2orbital, men energin för alla fem d orbitaler är densamma.
Form av f-Orbital
- Formen av f orbitalen är spridd. Eftersom värdet på l=3 för f-orbitalen är det minimala värdet för det primära kvanttalet n 4.
- De ekvivalenta ml-värdena för f orbitalen är (-3,–2, –1, 0, +1, +2, +3).
- Som ett resultat finns det sju f orbitaler för l = 3.

vad är desktop ini
Degenererade orbitaler
Degenererade orbitaler är de med samma energi. Dessa orbitaler är distinkta (de kan vara orienterade på olika sätt i rymden runt atomkärna ), men de har samma energi. I närvaro av ett externt fält är degenerationen av p-orbitalen opåverkad; emellertid kan degenereringen av f- och d-orbitalerna brytas genom att anbringa ett externt fält på systemet (antingen elektriskt eller magnetiskt fält).
Få orbitaler kommer att ha högre energi, medan andra kommer att ha lägre energi. Degeneration kommer inte längre att existera i systemet. Till exempel är d orbitaler uppbyggda av fem degenererade orbitaler som alla har samma energi.
Läs mer:
- Molecular Orbital Theory
- Fyllning av orbital i en atom
- Hybridisering
Vanliga frågor om former av atomorbitaler
Fråga 1: Hur fungerar orbitaler?
skådespelare zeenat aman
Svar:
En atomorbital är ett matematiskt uttryck som uttrycker det vågliknande beteendet hos en elektron eller ett elektronpar i en atom i atomteori och kvantmekanik. Varje orbital kommer att ta upp maximalt två elektroner, var och en med sin egen mängd spin.
Fråga 2: Vad är Nodal Plane?
Svar:
Planet där sannolikheten att hitta en elektron är försumbar eller noll kallas nodplanet.
sträng java
Fråga 3: Hur många orbitaler finns det?
Svar:
Eftersom s-undernivån bara har en omloppsbana, kan endast två elektroner vara närvarande. Eftersom p-subnivån omfattar tre orbitaler, kan maximalt sex elektroner vara närvarande. Eftersom d-subnivån omfattar 5 orbitaler kan maximalt 10 elektroner vara närvarande. Och var och en av de fyra undernivåerna har sju orbitaler som kan innehålla maximalt 14 elektroner.
Fråga 4: Vilka orbitaler har högst energi?
Svar:
java lokaldatum
Orbital 1s har mest energi. En elektrons energi är mängden energi som krävs för att få den ut ur atomens elektriska bubbla.
Fråga 5: Vad är skillnaden mellan ett skal och en orbital?
Svar:
I en atom är ett skal en samling underskal av samma kvantantalteori, n. Orbitaler har vardera två elektroner, och elektroner i samma orbital har samma definition av storlek, rörelsemängdsstorlek och magnetiskt kvanttal.
Fråga 6: Vad är sigma- och pi-bindningen?
Svar:
Atomorbital överlappning skapar sigma- och pi-bindningar. Sigma-bindningar skapas av överlappande atomomloppslober, medan Pi-bindningar genereras när en atomomloppslob överlappar en annan.
