Aufbau-principen är den grundläggande metoden som berättar för oss hur elektronerna fylls i atomomloppet. Enligt Aufbau-principen följer fyllningen av elektronerna i en atoms grundtillstånd ett grundläggande mönster. Denna princip säger oss att elektronerna i atomomloppsbanan för alla atomer är fyllda i stigande ordning av sin energi och för att hitta energin i atombanan följer de n+l-regeln.
Strukturprincip
I den här artikeln kommer vi att lära oss om Aufbau-principen, egenskaperna hos Aufbau-principen, dess undantag och begränsningar i detalj.
Definition av strukturprincip
Aufbaus princip säger det
Elektroner i olika orbitaler fylls i stigande ordning av sin energi, det vill säga orbitalen med lägst energi fylls först och orbitalen med högst energi fylls sist.
Ordet 'Aufbau' på tyska betyder 'bygga upp'. Bildning av orbitaler innebär att orbitaler fylls med elektroner. Den säger att elektronerna i atomorbitaler är fyllda i stigande ordning av energin i atomorbitalen. Och energin för atomomloppet beräknas med hjälp av n+l-regeln som anger om elektronen med ett högre nummer av n+l-värdet har den högre energin. I regeln som diskuterades i föregående rad, n berättar Principal Quantum nummer och l berättar Azimuthal Quantum nummer.
Om två elektroner har samma värde på n+l så är elektronen med ett mindre värde på n har den mindre energin och fylls först. Ordningen för att fylla elektronerna i en atomomloppsbana diskuteras nedan.
Principdiagrammets struktur
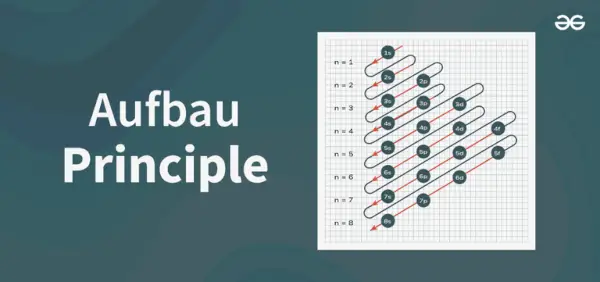
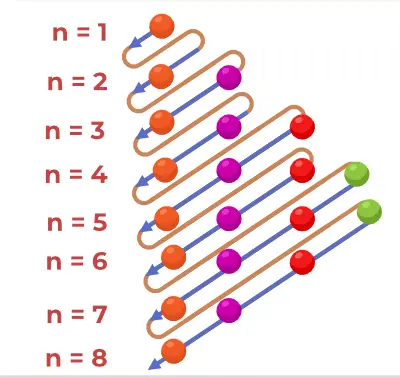
Aufbau principdiagram är diagrammet som visar ordningen för att fylla elektronerna i en atom.
Principdiagrammets struktur
Principformelns struktur
Aufbaus principformel är formeln som anger i vilken ordning elektronerna fylls i atomomloppsbanan. Atomomloppsformeln är
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Principstruktur Klass 11
Aufbau Principle är en viktig princip i kemi för eleverna i klass 11. Denna princip säger att,
Elektronerna i en atoms atomomloppsbana fylls i stigande ordning av energin i atomomloppsbanan som beräknas med hjälp av (n+l)-regeln.
Rita strukturdiagrammet
Aufbau Diagram ritas med hjälp av stegen som läggs till nedan,
- Hitta antalet elektroner som ska fyllas i atomerna.
- Vi vet att i en atom
- s-orbital kan innehålla maximalt 2 elektroner.
- p-orbital kan innehålla maximalt 6 elektroner.
- d-orbital kan innehålla maximalt 10 elektroner.
- f-orbital kan innehålla maximalt 14 elektroner.
- Fyll i de två första elektronerna i 1s orbitalen.
- Följ sedan n+l-regeln och fyll sedan elektronerna därefter.
Framträdande egenskaper hos strukturprincipen
Olika funktioner i Aufbau-principen är,
- Energin hos en orbital beror på summan av värdena för det huvudsakliga kvanttalet (n) och det azimutala summanumret (I). Detta kallas (n + l) regel . Enligt denna regel,
- I en neutral isolerad atom, ju lägre värdet på (n + l) för en orbital, desto lägre är dess energi. Men om två olika typer av orbitaler har samma värde (n + l), så har orbitaler med ett lägre värde på n mindre energi.
| Typ av orbital | Värde av n | Värdet av l | Värde på n+l | Relativ energi |
|---|---|---|---|---|
| 1s char till heltal java | 1 | 0 | 1+0 = 1 | Lägst energi |
| 2s | 2 | 0 | 2+0 = 2 | Högre energi än 1s orbital |
| 2p byt namn på linux-katalogen 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p orbitaler(n=2) har lägre energi än 3s(n=3) orbitaler. |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p orbitaler(n=3) har lägre energi än 4s(n=4) orbitaler. |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d orbitaler(n=3) har lägre energi än 4p(n=4) orbitaler. |
Av beskrivningen som ges i tabellen följer att energierna för de olika orbitalerna ökar med ökningen av antalet av huvudkvanttalet.
- Alltså den ordning i vilken elektronerna är fyllda i atomomloppsbanan atom är, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Elektronisk konfiguration med Aufbau-principen
De elektronisk konfiguration att använda Aufbau-principen för några element diskuteras nedan:
Elektronkonfiguration av svavel
Atomnummer svavel är 16, dvs den har 16 elektroner
Genom att använda Aufbau-principen skrivs svavelets elektroniska konfiguration som,
[S] = 1s 2 2s 2 2p 6 3s 2 3p 4
Elektronkonfiguration av kväve
Atomnummer för kväve är 7, det vill säga det har 7 elektroner
Genom att använda Aufbau-principen skrivs den elektroniska konfigurationen av kvävet som,
[N] = 1s 2 2s 2 2p 3
Undantag från konstruktionsprincipen
Det finns några undantag från Aufbau-principen som är krom och koppar. Deras elektroniska konfiguration är,
Elektronisk konfiguration av Chromium
Den elektroniska konfigurationen av Chromium enligt Aufbau-principen bör vara
- Cr(24): [Ar]3d 4 4s 2
Men ovanstående konfiguration är inte korrekt eftersom den faktiska elektroniska konfigurationen av Chromium(Cr) är,
- Cr(24): [Ar]3d 5 4s 1
Anledningen till denna elektroniska konfiguration är att halvfylld d-atomorbital är mer stabil än omloppsbanan fylld enligt Aufbau-principen.
Elektronisk konfiguration av koppar
Den elektroniska konfigurationen av koppar enligt Aufbau-principen bör vara,
- Cu(29): [Ar]3d 9 4s 2
Ovanstående konfiguration är inte korrekt eftersom den faktiska elektroniska konfigurationen av Copper(Cu) är,
- Cu(29): [Ar]3d 10 4s 1
Anledningen till denna elektroniska konfiguration är att full-fylld d-atomic orbital är mer stabil än omloppsbanan fylld enligt Aufbau-principen.
Läs mer
- Kvantnummer
- Formen på atomorbitaler
- Atomstruktur
Strukturprincip – Vanliga frågor
Vad är Aufbau-principen i kemi?
Aufbau-principen i kemi är den grundläggande principen som används för att fylla elektronerna i atomorbitalerna hos vilken atom som helst. Denna sats berättar för oss i vilken ordning elektronerna fylls i atomomloppsbanan.
Vem gav Aufbau-principen?
Aufbau-principen gavs av den berömda danske fysikern Niels Bohr 1920.
Vad är Paulis uteslutningsprincip?
Paulis uteslutningsprincip säger att i en atom inte två elektroner har alla fyra kvantnummer t han samma. Åtminstone ett av kvantnumret är olika för alla elektroner i atomen.
Vad är n+l-regeln?
n+l-regeln är regeln som anger att energin för en orbital beror på summan av Principal Quantum Number(n) och Azimuth Quantum Number(l). denna regel kallas (n+l)-regeln.
Vilka är undantagen från Aufbau-principen?
Undantaget från Aufbau-principen är,
göra ett skalskript körbart
- Elektronisk konfiguration av Chromium Cr[24]
- Elektronisk konfiguration av koppar Cu[29]
