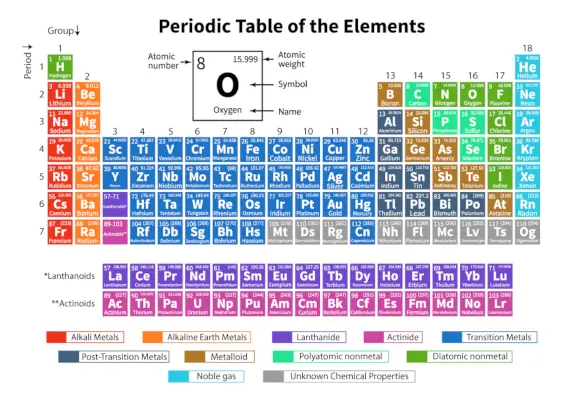
De Periodiska systemet av grundämnen är ett systematiskt arrangemang av 118 kända kemiska grundämnen. Dessa kemiska grundämnen är organiserade i ordning efter ökande atomnummer. De horisontella raderna från vänster till höger kallas perioder medan de vertikala kolumnerna uppifrån och ned kallas grupper i ett periodiskt system.
Innehållsförteckning
- Vad är det periodiska systemet?
- Lista över periodiska systemets element
- Viktiga termer i det periodiska systemet
- Klassificering av grundämnen i det periodiska systemet
- Mendeleev periodiska systemet
- Vanliga frågor om det periodiska systemet
Vad är det periodiska systemet?
Ett periodiskt system är en tabellform där alla kända kemiska grundämnen är ordnade i horisontella rader som kallas perioder och vertikala kolumner som kallas grupper baserat på deras atomnummer respektive atomstruktur.
Det är ett arrangemang av alla kända grundämnen och ger därför information om elementen såsom deras massa, elektronnummer, elektronkonfiguration och deras unika kemiska egenskaper.
Lista över periodiska systemets element
Här är tabellen som representerar 118 element i det periodiska systemet. Elementen som listas är ordnade efter den ökande ordningen av atomnummer och deras respektive atomvikt, symbol, densitet och elektronegativitet.
| Grundämnen i det periodiska systemet med atommassa | |||||
|---|---|---|---|---|---|
| Atomnummer | Namn på kemiskt element | Symbol | Atommassa (amu) | Densitet (g/cm 3 ) | Elektronnegativitet |
| 1 | Väte | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Helium | han | 4,0026 | 0,0001785 | – |
| 3 | Litium | Den där | 6,941 | 0,534 | 0,98 |
| 4 | Beryllium | Vara | 9,0122 | 1,85 | 1,57 |
| 5 | Bor | B | 10,811 | 2,34 | 2.04 |
| 6 | Kol | C | 12,0107 | 2,267 | 2,55 |
| 7 | Kväve | N | 14,0067 | 0,0012506 | 3.04 |
| 8 | Syre | O | 15,9994 | 0,001429 | 3,44 |
| 9 | Fluor | F | 18,9984 | 0,001696 | 3,98 |
| 10 | Neon | Ja | 20,1797 | 0,0009002 | – |
| elva | Natrium | Redan | 22,9897 | 0,968 | 0,93 |
| 12 | Magnesium | Mg | 24 305 | 1,738 | 1.31 |
| 13 | Aluminium | Till | 26,9815 | 2.7 | 1,61 |
| 14 | Kisel | Ja | 28,0855 | 2 329 | 1.9 |
| femton | Fosfor | P | 30,9738 | 1,823 | 2.19 |
| 16 | Svavel | S | 32 065 | 2.07 | 2,58 |
| 17 | Klor | Cl | 35,453 | 0,0032 | 3.16 |
| 18 | Argon | Med | 39,948 | 0,001784 | – |
| 19 | Kalium | K | 39,0983 | 0,89 | 0,82 |
| tjugo | Kalcium | Den där | 40 078 | 1,55 | 1 |
| tjugoett | Skandium | Sc | 44,9559 | 2 985 | 1,36 |
| 22 | Titan | Av | 47,867 | 4,506 | 1,54 |
| 23 | Vanadin | I | 50,9415 | 6.11 | 1,63 |
| 24 | Krom | Cr | 51,9961 | 7.15 | 1,66 |
| 25 | Mangan | Mn | 54,938 | 7.21 | 1,55 |
| 26 | Järn | Tro | 55,845 | 7,874 | 1,83 |
| 27 | Kobolt | Co | 58,9332 | 8.9 | 1,88 |
| 28 | Nickel | I | 58,6934 | 8 908 | 1,91 |
| 29 | Koppar | Med | 63,546 | 1.9 | 60 |
| 30 | Zink | Zn | 65,39 | 1,65 | 70 |
| 31 | Gallium | Här | 69,723 | 1,81 | 19 |
| 32 | Germanium | Ge | 72,64 | 2.01 | 1.5 |
| 33 | Arsenik | Som | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selen | HAN | 78,96 | 2,55 | 0,05 |
| 35 | Brom | Br | 79 904 | 2,96 | 2.4 |
| 36 | Krypton | NOK | 83,798 | 3 | 1×10−4 |
| 37 | Rubidium | Rb | 85,4678 | 0,82 | 90 |
| 38 | Strontium | Sr | 87,62 | 0,95 | 370 |
| 39 | Yttrium | OCH | 88 906 | 1.22 | 33 |
| 40 | Zirkonium | Zr | 91,224 | 1,33 | 165 |
| 41 | Niob | Obs | 92,906 | 1.6 | tjugo |
| 42 | Molybden | Mo | 95,94 | 2.16 | 1.2 |
| 43 | Teknetium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Rutenium | Ru | 101,07 | 2.2 | 0,001 |
| Fyra fem | Rodium | Rh | 102,91 | 2.28 | 0,001 |
| 46 | Palladium | Pd | 106,42 | 2.2 | 0,015 |
| 47 | Silver | På | 107,87 | 1,93 | 0,075 |
| 48 | Kadmium | CD | 112,411 | 1,69 | 0,159 |
| 49 | Indium | I | 114,82 | 1,78 | 0,25 |
| femtio | Tro | Sn | 118,71 | 1,96 | 23 |
| 51 | Antimon | Sb | 121,76 | 2.05 | 0,2 |
| 52 | Tellur | De | 127,6 | 2.1 | 0,001 |
| 53 | Jod | jag | 126,9045 | 2,66 | 0,45 |
| 54 | Xenon | Bil | 131,293 | 2.6 | 3×10−5 |
| 55 | Cesium | Cs | 132,91 | 0,79 | 3 |
| 56 | Barium | Inte | 137,327 | 0,89 | 425 |
| 57 | Lantan | De | 138,91 | 1.1 | 39 |
| 58 | Cerium | Detta | 140,12 | 1.12 | 66,5 |
| 59 | Praseodym | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodym | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Prometium | Pm | 145 | 1.13 | 2×10−19 |
| 62 | Samarium | Sm | 150,36 | 1.17 | 7.05 |
| 63 | Europium | Eu | 151 964 | 1.2 | 2 |
| 64 | Gadolinium | Gd | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Dysprosium | De där | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Till | 164,9303 | 1,23 | 1.3 |
| 68 | Erbium | Är | 167 259 | 1.24 | 3.5 |
| 69 | Thulium | Tm | 168,9342 | 1,25 | 0,52 |
| 70 | Ytterbium | Yb | 173,04 | 1.1 | 3.2 |
| 71 | Paris | Lu | 174,967 | 1,27 | 0,8 |
| 72 | Hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantal | Motstående | 180,9479 | 1.5 | 2 |
| 74 | Volfram | I | 183,84 | 2,36 | 1.3 |
| 75 | Renium | Re | 186,207 | 1.9 | 7×10−4 |
| 76 | Osmium | Du | 190,23 | 2.2 | 0,002 |
| 77 | Iridium | Och | 192,22 | 2.2 | 0,001 |
| 78 | Platina | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Guld | På | 196,97 | 2,54 | 0,004 |
| 80 | Merkurius | Hg | 200,59 | 2 | 0,085 |
| 81 | Tallium | Tl | 204,3833 | 1,62 | 0,85 |
| 82 | Leda | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Vismut | Med en | 208,9804 | 2.02 | 0,009 |
| 84 | Polonium | Efter | 209 | 2 | 2×10−10 |
| 85 | Astat | På | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4×10−13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radium | Sol | 226 | 0,9 | 9×10−7 |
| 89 | Aktinium | Och | 227 | 1.1 | 5,5×10−10 |
| 90 | Torium | Th | 232,0381 | 1.3 | 9.6 |
| 91 | Protaktinium | Väl | 231,0359 | 1.5 | 1,4×10−6 |
| 92 | Uran | I | 238,0289 | 1,38 | 2.7 |
| 93 | Neptunus | T.ex | 237 | 1,36 | ≤ 3×10−12 |
| 94 | Plutonium | Skulle kunna | 244 | 1,28 | ≤ 3×10−11 |
| 95 | Americium | Am | 243 | 1.13 | – |
| 96 | Curium | Centimeter | 247 | 1,28 | – |
| 97 | Berkelium | Bk | 247 | 1.3 | – |
| 98 | Kalifornien | Jfr | 251 | 1.3 | – |
| 99 | Einsteinium | Är | 252 | 1.3 | – |
| 100 | Fermium | Fm | 257 | 1.3 | – |
| 101 | Mendelejev | Md | 258 | 1.3 | – |
| 102 | Ädel | Nej | 259 | 1.3 | – |
| 103 | Lawrencium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rf | 267 | – | – |
| 105 | Dubnium | Db | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Röntgenium | Rg | 282 | – | – |
| 112 | Copernicus | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | I | 290 | – | – |
| 115 | Moscovium | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | Och | 294 | – | – |
Viktiga termer i det periodiska systemet
| Villkor hur man öppnar en fil med java | Beskrivning |
|---|---|
| Atomnummer | Antalet protoner som utgör ett grundämnes kärna kallas dess atomnummer (Z). t.ex. Kol innehåller då 6 protoner, så dess atomnummer måste bara vara 6. |
| Atomisk massa | Det definieras som medelmassan av atomerna i ett element. Det mäts på basis av den relativa naturliga förekomsten av elementets isotoper. Atomisk massa kallas också Atomvikt (A). Det mäts i atommassaenheten (amu). |
| Period | De horisontella raderna från vänster till höger i ett periodiskt system kallas perioder. Det finns totalt 7 perioder i det periodiska systemet. Elementen är ordnade horisontellt på grund av deras likheter i egenskaper, som samma atomära orbitaler och så vidare. |
| Grupp | De vertikala kolumnerna från topp till botten i ett periodiskt system kallas grupper. Det finns totalt 18 grupper i det periodiska systemet. Grundämnena är anordnade vertikalt på grund av deras likheter i egenskaper, eftersom de har samma antal valenselektroner i sig. |
| Symbol för ett element | En symbol är ett begrepp som används för att representera ett kemiskt element med hjälp av en bokstav eller en kombination av två till tre bokstäver. t.ex. Den kemiska symbolen för kol är C, medan Fe används för järn och så vidare. |
Klassificering av grundämnen i det periodiska systemet
De 118 elementen är ordnade i 7 perioder och 18 grupper som visas ovan. Vidare är elementen uppdelade i olika block.
| Blockera | Element ingår | Senaste elektronunderskalet fyllt |
|---|---|---|
| s-block | Grupp 1 (alkalimetaller) | s-subshell |
| Grupp 2 (alkaliska jordartsmetaller) | ||
| p-block | Grupp 13 (Boron Family) | p-subshell |
| Grupp 14 (kolfamilj) | ||
| Grupp 15 (kvävefamiljen) | ||
| Grupp 16 (syrefamiljen) | ||
| Grupp 17 (Fluorfamiljen) | ||
| d-block | Grupper 3 till 12 (övergångselement) | d-subshell |
| f-block | Lantanider (sällsynta jordartselement) | f-subshell |
| Aktinider |
Mendeleev periodiska systemet
För att representera likheter och trender i grundämnens beteende utvecklade Mendeleev det periodiska systemet, som är ett arrangemang av grundämnen i en ökande atommassaordning i tabellform.

Enligt Mendeleevs periodiska system ordnades grundämnen enligt deras grundläggande egenskaper, atommassa och kemiska egenskaper. Endast 63 element var kända vid tiden för Mendeleevs verk. I Mendelejevs periodiska system kallades den horisontella raden och de vertikala kolumnerna som grupper respektive perioder.
Men Mendeleevs periodiska system misslyckas på grund av många brister i det. Några av dem är att det misslyckades med att beteckna väte och ädelgaser i den. Dessutom var den ökande ordningen för grundämnenas atommassa inte regelbunden i hela tabellen. Till och med, upptäckten av isotoper bryter mot Mendeleevs periodiska lag.
Läs mer:
- Moderna periodiska systemet
- Mendeleev periodiska systemet
- Modern periodisk lag
- Periodiska systemets historia
- Atomstruktur
Vanliga frågor om det periodiska systemet
Vad är det periodiska systemet?
Det periodiska systemet är ett tabellarrangemang av kemiska grundämnen organiserade efter deras atomnummer, elektronkonfiguration och återkommande kemiska egenskaper. Tabellen är indelad i rader som kallas perioder och kolumner som kallas grupper eller familjer.
Vem upptäckte det periodiska systemet?
Det periodiska systemet för grundämnen upptäcktes inte av en enda person, men dess utveckling krediteras Dmitri Mendeleev, en rysk kemist, som arrangerade grundämnen baserat på deras egenskaper 1869.
Vem skapade det moderna periodiska systemet?
1913 introducerade Henry Moseley en uppdaterad version av det periodiska systemet, vanligtvis kallat The Modern Periodic Table.
Hur är det periodiska systemet uppställt?
Det periodiska systemet är ordnat i ordning efter ökande atomnummer, med element grupperade tillsammans baserat på liknande kemiska egenskaper och ordnade i perioder (rader) och grupper (kolumner).
Vad är atomnummer?
Antalet protoner som utgör ett grundämnes kärna kallas dess atomnummer (Z). t.ex. Kol innehåller 6 protoner, dess atomnummer måste bara vara 6.
Kan två olika grundämnen ha samma atomnummer?
Antalet neutroner i en atom från två olika grundämnen kan vara lika, men antalet protoner blir aldrig detsamma. Varje grundämne har ett visst antal protoner, vilket motsvarar antalet atomer.
Hur man beräknar atommassa?
Atommassan kan beräknas genom att addera massan av protoner och neutroner i ett grundämne.
Vad är en grupp i det periodiska systemet?
Kolumnen i det periodiska systemet hänvisar till gruppen av det periodiska systemet. Elementen i samma grupp har liknande fysikaliska och kemiska egenskaper.
